- 最新信息
-
- 热门信息
-
高度耐药结核病新药Pretomanid获批
发布人:系统管理员 发布日期:2019/10/9 来源:本站 浏览:次 字号:大 中 小
耐药结核病为全球卫生领域的一大难题,根据世界卫生组织发布的《2018年全球结核病报告》,每年约有1000万名新感染结核病患者,其中约60万人是耐药结核。目前大多数广泛耐药TB患者可能需要接受多达8种抗生素的治疗,疗程长达18个月或更长, 总体治愈率仅为55%。一项国内调查显示,普通肺结核家庭灾难性支出患者的比例达51%,耐多药肺结核家庭灾难性支出患者的比例高达80%。因此,耐药结核的治疗药物研发对于耐药结核患者的治疗具有重要意义。
近日,由非营利性组织结核病联盟(TB Alliance)开发的新型化合物Pretomanid(PA-824)已获美国FDA批准,作为三药、六个月全口服方案BPaL(由贝达喹啉、Pretomanid、利奈唑胺组成)的组成药物,用于无法耐受治疗/疗效欠佳的广泛耐药结核病(XDR-TB)或耐多药结核病(MDR-TB)患者(统称为“高度耐药结核病”)的治疗。
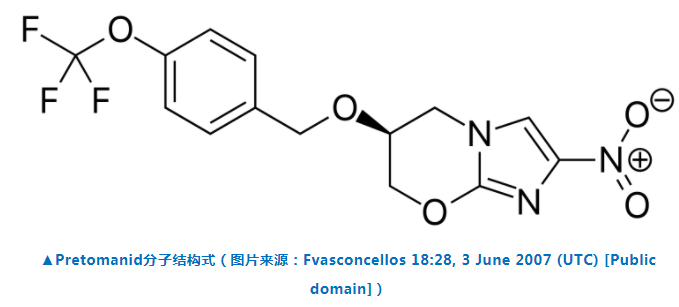
Pretomanid是一种新化学实体,属于名为硝基咪唑嗪类化合物。自从2002年TB Alliance开始开发pretomanid以来,该药已在14个国家对1000多人进行了临床试验。Pretomanid的新药申请包括了1168例患者的数据,这些患者在19项临床试验中接受了Pretomanid治疗。III期临床研究Nix-TB入组了109例XDR-TB以及药物不耐受或非反应性MDR-TB患者。数据显示,接受BPaL方案治疗6个月并在完成治疗后随访6个月,前107例患者中有95例患者取得了治疗成功,即临床感染得到解决、TB痰培养呈阴性。
Pretomanid是40多年来FDA批准的第三种新型抗结核药物,预计在年底前在美国上市。目前,该药也正在接受欧洲药品管理局(EMA)的审查。TB Alliance也已向世界卫生组织(WHO)提交了BPaL方案的临床数据,考虑将该方案纳入高度耐药结核病的治疗指南。
- 上一条:熔解曲线耐药结核检测技术的原理及应用
- 下一条:没有了


